Utilisation de la chloroquine en virologie (version détaillée de l’article)
Publié en ligne le 4 mai 2020 - Covid-19 -
L’auteur déclare ne jamais avoir reçu une rémunération quelle qu’elle soit, financière ou en nature, de la part d’un organisme privé, industriel ou commercial qui pourrait tirer profit ou avantage de l’article publié.
Un nouveau virus a fait son apparition en Chine le 17 novembre 2019, baptisé SARS-CoV-2 pour syndrome respiratoire aigu sévère, le deuxième du nom. Il est la cause de la maladie nommée Covid-19 (COronaVIrus Disease 2019). Ce virus s’est rapidement propagé dans le monde et l’état de pandémie a été déclaré par l’OMS le 11 mars 2020. Il s’agit d’un grand virus (100-160 nm) possédant un génome ARN positif simple brin1. Il appartient à la famille des Coronaviridae, qui comprend plusieurs virus humains et animaux. Le nom de ces virus provient de la présence de spicules boursouflées à leur périphérie (protéine Spike), visibles en microscopie électronique et rappelant une couronne. Dans cette famille, nous trouvons deux genres qui concernent la santé humaine : le genre Alphacoronavirus dans lequel figurent les coronavirus humains 229E et NL63 (faisant partie des virus responsables du rhume commun), et le genre Betacoronavirus, dans lequel figurent les coronavirus HKU24, OC43 (également responsables du rhume commun), Middle East respiratory syndrome-related coronavirus (Mers-CoV) et Severe acute respiratory syndrome-related coronavirus (SARS-CoV). Les quatre premiers sont des coronavirus saisonniers, responsables (entre autres virus) du rhume commun. Le Mers-CoV est le plus dangereux avec une mortalité d’environ 30 % selon l’OMS. Il circule toujours sur la péninsule arabique. Le SARS-CoV, premier du nom, a été responsable de l’épidémie de syndrome respiratoire aigu sévère (Sras) en 2002-2003. Le SARS-CoV-2 est très proche du SARS-CoV, avec lequel il partage 79,6 % de similarité de génome [1].
Le nouveau coronavirus possède un taux de reproduction de base (R0), c’est-à-dire le nombre de cas secondaires à partir d’une personne infectée, estimé entre 1,4 et 5,5. Il semblerait que les formes cliniques pauci-symptomatiques (présentant peu de symptômes) soient les formes prédominantes, suivies des formes symptomatiques bénignes, puis les formes sévères (35 %) et critiques (5 %) [2]. En France, au 19 avril 2020, 112 606 cas ont été détectés et 19 718 décès constatés [3]. Aucun traitement curatif n’existe à ce jour, la prise en charge reposant sur le traitement des symptômes et des complications lors des formes sévères (soins de réanimation). Plusieurs molécules, efficaces in vitro, sont en cours d’évaluation dans des essais cliniques. L’association lopinavir/ritonavir, efficace in vitro, s’est montrée inefficace lors d’un essai clinique randomisé [4]. Une classe de médicaments attire particulièrement l’attention des médias : la chloroquine et ses dérivés. Elle fut médiatisée par le professeur Didier Raoult dans une vidéo intitulée « Fin de partie pour le coronavirus » (renommée depuis « Coronavirus : vers une sortie de crise »), diffusée le 26 février 2020 (disponible sur YouTube et sur le site de l’IHU Méditerranée-Infection). Une polémique divise actuellement la communauté médicale à propos de l’efficacité présumée de cette molécule, certains plaidant pour un large recours et un traitement empirique à la chloroquine de tout patient infecté, d’autres prônant la prudence et recommandant d’attendre les résultats d’essais randomisés correctement conduits.
La chloroquine et ses dérivés
La chloroquine et ses divers dérivés sont des molécules qui possèdent toutes une structure de base identique appelée 4-aminoquinoline. Il s’agit de composés organiques synthétisés à partir de la quinoléine. Le dérivé le plus courant est le sulfate de chloroquine, utilisé depuis de nombreuses années dans le traitement prophylactique (c’est-à-dire préventif) et curatif du paludisme (Nivaquine®). Le phosphate de chloroquine est également utilisé comme traitement anti-paludéen, notamment en association avec le chlorhydrate de proguanil (Sararine®). Enfin, le dernier dérivé notable est le sulfate d’hydroxychloroquine (Plaquenil®), dont l’autorisation de mise sur le marché (AMM) concerne le traitement d’affections rhumatologiques (polyarthrite rhumatoïde) et dermatologiques (lupus érythémateux, lucites). Il est également utilisé dans le traitement de la maladie de Whipple ou la fièvre Q, deux infections causées par des bactéries intracellulaires. L’hydroxychloroquine est un dérivé connu pour être mieux toléré et moins toxique que la chloroquine.

L’autorisation de mise sur le marché (AMM) d’un produit pharmaceutique est accordée pour des indications thérapeutiques validées (« la maladie ou les symptômes que le médicament est capable de traiter ou de prévenir, ou encore sur le diagnostic qu’il permet d’établir » [1]) et une posologie précise. Ces indications sont décrites dans la notice d’utilisation.
En vertu de l’article R.4127-8 du code de la santé publique, « le médecin est libre de ses prescriptions qui seront celles qu’il estime les plus appropriées en la circonstance ». Il peut ainsi prescrire un médicament « hors AMM » (pour les indications, pour la posologie ou pour la durée) dans des conditions particulières, énoncées dans l’article L 5121-12-1 du code de la santé publique [2]. Il faut en particulier une « absence d’alternative médicamenteuse appropriée disposant d’une autorisation de mise sur le marché » et que « le prescripteur juge indispensable, au regard des données acquises de la science, le recours à cette spécialité pour améliorer ou stabiliser l’état clinique de son patient ». En outre, le médecin a obligation d’informer son patient que la prescription n’est pas conforme à son AMM, ainsi que « des risques encourus et des contraintes et des bénéfices susceptibles d’être apportés ». Enfin, il doit porter sur l’ordonnance la mention « Prescription hors autorisation de mise sur le marché » (ce qui aura, en outre, pour conséquence que le médicament ne sera pas remboursé par la sécurité sociale). De son côté, le pharmacien a le droit de refuser la délivrance du produit « lorsque l’intérêt de la santé du patient lui paraît l’exiger » (article R4235-61 du code de santé publique).
Comme le rappelait l’Académie nationale de médecine en 2018 [2], « l’AMM étant un cadre contraignant mais protecteur, prescrire hors AMM est a priori une pratique à risque pour le patient qui engage le prescripteur et le pharmacien ». Elle estimait à 20 % le nombre de prescriptions hors AMM et distinguait celles qui sont injustifiables de celles jugées « indispensables à une bonne prise en charge de certains patients, en particulier enfants, personnes âgées, femmes enceintes ».
La responsabilité ordinale, civile et pénale du médecin est engagée dès lors qu’il prescrit « hors AMM » [3]. Il doit en particulier être à même de prouver que la prescription s’est faite « au regard des données acquises de la science » et ne peut proposer aux malades « un remède ou un procédé illusoire ou insuffisamment éprouvé » (article 4127-39 du code de santé publique). On se souvient de l’affaire du Mediator, dont l’une des facettes était la prescription hors AMM en tant que « coupe-faim ».
À ce jour, en ce qui concerne le recours à l’hydroxychloroquine pour lutter contre la Covid-19, en l’absence d’essais comparatifs randomisés (répartition aléatoire entre le groupe traitement et le groupe contrôle) et en l’absence de consensus dans la communauté scientifique internationale, il semble difficile d’invoquer « les données acquises de la science ». De toute façon, un décret ministériel en date du 26 mars 2020 réserve la prescription de l’hydroxychloroquine aux établissements de santé qui prennent en charge les malades atteints de Covid-19.
1 | Glossaire du ministère des Solidarités et de la Santé.
2 | Académie nationale de médecine et Académie nationale de pharmacie, « Les prescriptions médicamenteuses hors AMM (autorisation de mise sur le marché) en France. Une clarification est indispensable », 21 novembre 2018.
3 | Laude A, « Dans la tourmente du Mediator : prescription hors AMM et responsabilités », Recueil Dalloz, 27 janvier 2011.
Physiopathologie et mécanismes d’actions supposés
Les propriétés physiopathologiques proposées pour suggérer une action de la chloroquine sur les infections virales ne manquent pas et ont été montrées in vitro [5]. D’abord, la chloroquine agirait avant même la rencontre avec le virus en interférant dans le processus de reconnaissance et de liaison du virus avec la cellule qu’il tente d’infecter . Cette propriété a été documentée sur le virus SARS-CoV premier du nom.
La chloroquine aurait également comme action, une fois le virus entré dans la cellule, de modifier l’acidité de compartiments cellulaires appelés endosomes, par lesquels les particules virales pénètrent dans la cellule. L’acidité endosomale permet normalement la destruction de la capside (c’est-à-dire la « coque » du virus) et ainsi la libération des acides nucléiques et des protéines nécessaires à l’initiation du cycle du virus [5]. L’alcalinisation endosomale engendrée par la chloroquine inhiberait ainsi l’initiation du cycle viral.
La chloroquine interfère également dans le processus de maturation des protéines virales qui a lieu dans deux compartiments de la cellule (le réticulum endoplasmique et l’appareil de Golgi). Dans ces compartiments, le pH est acide. Dans le cas du virus de l’immunodéficience humaine (VIH), responsable du sida, la chloroquine interférerait dans le processus de maturation de la protéine d’enveloppe gp120, ce qui aboutirait à la synthèse de particules virales non infectieuses. Un processus similaire a également été retrouvé dans le cas du virus de la dengue [5].
Enfin, la chloroquine présente des propriétés anti-inflammatoires. C’est pour ces propriétés notamment qu’elle est utilisée dans le traitement d’affections rhumatologiques. Elle inhibe l’action d’un certain nombre de molécules pro-inflammatoires. Dans le cas du SARS-CoV-2, il a été retrouvé une forte corrélation entre l’augmentation de certaines de ces molécules inflammatoires et la gravité de l’infection [6]. En effet, l’évolution défavorable de l’infection serait liée à une « phase immunitaire », qui succéderait à la « phase virologique ». C’est à partir de cette phase immunitaire qu’une prise en charge en réanimation devient nécessaire. Malgré cette action anti-inflammatoire, c’est pendant la phase initiale avant l’« orage immunologique », voire en prévention, donc avant l’apparition de la maladie, que l’hydroxychloroquine est proposée par ses partisans. Beaucoup d’études in vitro ont montré que la chloroquine présente un large panel d’effets antiviraux non spécifiques d’un virus donné [5].
Chloroquine et virologie : les études in vitro
L’efficacité in vitro (c’est-à-dire en laboratoire, et non sur un organisme animal ou humain) de la chloroquine en virologie, d’une façon générale, est connue depuis bien longtemps. En 1966, une étude indiquait que cette molécule diminuait la croissance du virus de l’hépatite murine, le virus modèle historique dans l’étude des coronavirus [7]. En 1984, une autre étude faisait état d’une efficacité in vitro de la chloroquine sur la croissance du virus de la rage dans un modèle de culture cellulaire [8]. En 1989, une étude rapporte une efficacité sur plusieurs Arenavirus (virus Pichinde, Mopeia et Lassa) [9]. En 1991, c’est contre le virus de la poliomyélite que la chloroquine montre son efficacité (toujours in vitro) [10]. Une étude a même montré en 1993 l’efficacité de l’hydroxychloroquine sur le virus de l’immunodéficience humaine (VIH-1) [11]. Puis à l’occasion de l’épidémie de Sras en 2003, la chloroquine a été testée contre le virus SARS-CoV qui en était la cause. Une forte inhibition de la croissance virale a été montrée sur des cultures cellulaires, que la molécule (la chloroquine) ait été introduite avant ou après exposition au virus, suggérant une possible efficacité en prophylaxie en plus d’une efficacité thérapeutique [12]. Par la suite, d’autres études ont également montré une efficacité sur les virus responsables du chikungunya [13], de la dengue [14] ou encore de la fièvre hémorragique de Crimée-Congo [15].
La chloroquine et ses dérivés sont donc connus pour être actifs in vitro sur un large panel de virus appartenant à des familles différentes. Concernant le SARS-CoV-2, plusieurs études ont établi une efficacité in vitro [16], [17], [18] . L’hydroxychloroquine serait aussi efficace que la chloroquine, mais moins toxique sur les cellules [16].
Chloroquine et virologie : les études in vivo
L’efficacité chez l’animal a été testée dans un certain nombre de cas. Dans le modèle murin (souris ou rat par exemple), la chloroquine est associée à une augmentation de la réplication des virus de la forêt de Semliki et de l’encéphalomyocardite du porc, avec une augmentation de la mortalité [19]. Aucune efficacité n’a été trouvée sur les souris et les furets infectés par le virus influenza A responsable de la grippe [20]. Même constat dans une étude sur le modèle cochon d’Inde infecté par le virus Ebola, malgré une efficacité in vitro [21]. Ou encore sur le modèle hamster infecté par les virus Hendra et Nipah [22]. A contrario, des souris infectées par le virus Zika et traitées par chloroquine voient leur survie améliorée et la transmission du virus par voie materno-fœtale diminuer [23]. Aucun essai clinique chez l’Homme n’a, à notre connaissance, été réalisé dans le cas du virus Zika. La chloroquine a également été testée sur le modèle primate non-humain infecté par le virus du chikungunya [24]. Dans cette étude, les singes traités par chloroquine développaient des formes aiguës plus graves, avec une virémie (une présence de virus dans le sang) plus importante. À notre connaissance, au moment de la rédaction de cet article, aucune étude concernant le SARS-CoV-2 n’a été publiée sur un modèle animal.
Des essais cliniques sur l’Homme ont par ailleurs déjà été entrepris pour tester l’efficacité de la chloroquine sur divers virus. En 2009, une équipe de Singapour a réalisé un essai clinique randomisé, en double aveugle, contre placebo (voir encadré) pour évaluer la chloroquine en prévention de l’infection par le virus influenza (responsable de la grippe). Ils ont recruté 1 516 patients non malades et les ont suivis durant douze semaines en hiver [25]. Le groupe chloroquine recevait 500 mg par jour de chloroquine pendant une semaine, puis 500 mg une fois par semaine jusqu’à la fin de l’étude. Les patients étaient suivis par questionnaires médicaux journaliers. Au total, dans le groupe traité par chloroquine, 38 patients ont déclaré des symptômes (soit 5 %) et douze d’entre eux ont été confirmés biologiquement comme grippés (soit 2 %). Dans le groupe placebo, 29 patients ont déclaré des symptômes (4 %) dont huit (1 %) confirmés biologiquement. Aucune différence statistique entre les deux groupes n’a donc été retrouvée.
Selon la Haute autorité de santé [1], « dès lors qu’une évaluation clinique a pour but de comparer l’efficacité de deux traitements, l’essai contrôlé randomisé en double aveugle bien conduit est le type d’étude offrant le meilleur niveau de preuve, permettant d’étayer des décisions médicales et d’évaluer l’efficacité de ces traitements ». Et seuls certains cas particuliers peuvent justifier de se soustraire à ces exigences (impossibilité de randomiser, difficulté de mise en œuvre du double aveugle, etc.).
Essai contrôlé. L’essai doit permettre une évaluation des effets du traitement par comparaison à un groupe qui n’aura pas reçu le traitement. Ce « groupe contrôle » (ou « groupe témoin ») pourra recevoir un placebo, le traitement de référence, si celui-ci existe ou un autre médicament déjà connu. Comme le souligne l’Académie nationale de médecine [2], « le choix du placebo ou d’un “médicament de référence’’ dans le groupe témoin est un problème complexe car l’utilisation d’un placebo en monothérapie n’est possible que si elle n’entraîne pas de perte de chance thérapeutique pour les patients qui y sont soumis ».
Essai randomisé. Les deux groupes comparés doivent avoir des profils les plus semblables possible, pour limiter l’introduction de biais qui pourraient rendre compte de tout ou partie des effets observés. Une affectation à l’un ou l’autre groupe effectuée de façon aléatoire est la mieux à même d’assurer cette bonne comparabilité.
En double aveugle. Le « double aveugle » (ou « double insu ») permet de s’affranchir de toute subjectivité (du patient et de l’investigateur de l’essai). L’un et l’autre ignorent si le patient appartient au groupe « traitement » ou au groupe de contrôle.
En outre, les objectifs de l’étude et les critères de mesure doivent être précisément décrits au démarrage de l’essai clinique : « en effet, l’hypothèse principale qui est à l’origine de l’essai, débouche sur un objectif principal (ce que l’on veut confirmer) et donc sur la définition d’un seul critère de mesure d’effet qui doit être parfaitement relié à l’hypothèse et à l’objectif principaux » [2]. De même, la taille de l’échantillon inclus dans l’étude doit être en rapport avec l’objectif recherché.
1 | Haute autorité de santé, « Choix méthodologiques pour le développement clinique des dispositifs médicaux », Guide méthodologique, 4 octobre 2013.
2 | Académie nationale de médecine, « L’essai clinique contrôlé randomisé », séance du 3 avril 2007.
Comme indiqué précédemment, une efficacité in vitro a été trouvée contre le virus VIH. Bien sûr, devant l’espoir que cela avait engendré, des essais cliniques ont été réalisés. En 2002, des chercheurs du Département des maladies infectieuses de Singapour observent une diminution de la charge virale sur une petite cohorte de seize patients traités par chloroquine, hydroxycarbamide et didanosine [26]. Il est difficile de tirer une conclusion quant à l’efficacité des composés isolés utilisés dans cette petite cohorte, sans groupe contrôle par ailleurs. Les mêmes auteurs ont donc conduit en 2012 un essai randomisé en double aveugle contre placebo sur 83 patients présentant une infection par le VIH à un stade encore précoce (asymptomatique) et ne prenant aucune thérapie antirétrovirale. Les patients ont été traités avec 400 mg d’hydroxychloroquine pendant 48 semaines. Les conclusions de l’étude sont sans appel : une diminution significative de la quantité de lymphocytes CD4+ dans le groupe hydroxychloroquine et une augmentation de la charge virale. Ces résultats sont les marqueurs d’une évolution défavorable de la maladie [27].
Des essais cliniques sur les virus transmis par les arthropodes suceurs de sang (moustiques, tiques) ont également été réalisés. Concernant le virus de la dengue, un essai randomisé en double aveugle contre placebo sur 307 patients au Vietnam n’a pas pu mettre en évidence une réduction de la présence du virus dans le sang, ni une diminution de la présence dans le corps d’antigènes NS1, marqueur biologique d’une infection en cours [28]. Lors de l’épidémie de chikungunya à La Réunion en 2006, une cohorte de patients a été incluse dans un essai randomisé en double aveugle contre placebo. Vingt-sept patients ont reçu le placebo et vingt-sept autres ont reçu de la chloroquine avec une dose de 600 mg/j pendant trois jours puis 300 mg/j durant deux jours. Aucune différence significative n’a été mise en évidence, ni sur la durée de la fièvre, ni sur la durée de la virémie [29].
Dans la lutte contre la Covid-19
Concernant le SARS-CoV-2 responsable de l’actuelle pandémie de Covid-19, au moment de la rédaction de cet article, seuls les résultats de sept études cliniques étaient disponibles [30], [31], [32], [33], [34], [35], [36]. Le 16 mars 2020, des chercheurs chinois annoncent dans une lettre à l’éditeur de la revue BioScience Trends que la chloroquine a montré son efficacité sur plus de cent patients traités en Chine [37]. L’efficacité de la molécule portait sur la diminution du taux d’exacerbation des pneumonies, l’amélioration de la radiologie pulmonaire, la diminution de la charge virale et la durée de la maladie. Pour autant, aucune donnée n’était rapportée. Les auteurs citaient notamment quinze essais cliniques lancés en Chine mi-février. Ces études semblent toujours en cours pour douze d’entre elles, deux ont été mises en pause et une a été arrêtée faute d’un nombre suffisant de patients (numéro d’accès ChiCTR2000029760). C’est à partir de ces travaux que l’équipe du Pr Raoult, à Marseille, va commencer à faire parler d’elle en publiant plusieurs études, mais aussi en intervenant activement sur les réseaux sociaux.
La première étude marseillaise est un essai non randomisé non en aveugle sur 26 patients traités par 600 mg/j d’hydroxychloroquine pendant dix jours [31]. Le critère d’efficacité était la négativation de la PCR virale (polymerase chain reaction, technique d’amplification qui permet de détecter des particules virales présentes en très petites quantités) sur prélèvement naso-pharyngé à J6. Seize patients, traités dans des centres hospitaliers alentour ont servi de groupe contrôle. Sur les 26 patients traités, six ont été ce que l’on appelle « perdus de vue » : un patient est décédé (malgré une charge virale négative la veille), trois ont été admis en réanimation, un patient a été transféré sur un autre site et le dernier a arrêté de lui-même le traitement. Selon les auteurs, 100 % des patients traités par hydroxychloroquine et azithromycine (un antibiotique) étaient négatifs en PCR à J6, contre 57 % dans le groupe hydroxychloroquine seul, et 13 % dans le groupe témoin. Cette étude a été largement contestée sur le plan méthodologique et l’interprétation de ses résultats permet difficilement de tirer des conclusions [38].
Le deuxième article est un essai non contrôlé non comparatif sur 80 patients présentant une forme clinique classée comme non grave sur la base du score clinique « national early warning score » (NEWS) [33]. Les patients étaient traités par hydroxychloroquine, 600 mg/j pendant dix jours, et par azithromycine pendant quatre jours. L’efficacité du traitement était évaluée sur l’amélioration clinique, la durée de positivité de la PCR et la durée d’hospitalisation. L’état de santé de soixante-dix-huit patients s’est amélioré cliniquement, un est décédé et un a été admis en réanimation. La PCR est devenue négative à hauteur de 98 % à J8. Encore une fois, l’absence de groupe contrôle rend impossible toute interprétation, l’évolution « naturelle » de la maladie étant probablement assez proche de celle décrite chez ces patients [2].
Une équipe chinoise a également publié un article dans une revue universitaire [30]. Malheureusement, seul le résumé en anglais est disponible, l’article lui-même étant en chinois. Il s’agissait d’un essai randomisé sur quinze patients traités par hydroxychloroquine à 400 mg/j pendant cinq jours. Les quinze patients du groupe contrôle recevaient les soins standards classiques. Aucune différence n’a été trouvée entre les deux groupes, ni sur le taux PCR négatives à J7, ni sur la durée d’hospitalisation, ni sur l’évolution sur le plan radiologique des poumons.
Une autre équipe chinoise a réalisé un essai randomisé [32]. Ici aussi, les patients étaient répartis en deux groupes : le premier (douze personnes) recevait l’association lopinavir/ritonavir, qui par la suite s’est avérée inefficace [4]. Le second groupe (dix personnes) recevait de la chloroquine à 500 mg/j pendant dix jours. Les mêmes critères que dans l’étude précédente ont été utilisés pour juger de l’efficacité du traitement. Les auteurs ont trouvé une « légère » diminution de la charge virale dans le groupe chloroquine à J7, J10 et J14, sans aucun test statistique permettant d’évaluer le caractère significatif ou non de cette petite différence. Curieusement, les détails de ce résultat, défini par les auteurs comme un critère de jugement principal de cette étude, ne sont pas présentés dans l’article, et ne le sont seulement que dans les annexes. De plus, les patients traités par chloroquine ont été traités plus tôt après le début des symptômes cliniques que dans l’autre groupe (2,5 jours vs. 6,5 jours en moyenne). Concernant l’amélioration sur le plan de l’imagerie pulmonaire, les patients sous chloroquine récupèrent mieux que ceux de l’autre groupe, mais là encore, aucun test statistique n’est fourni, ni plus de détails quant aux critères d’évaluation que l’on sait « opérateur dépendants » car ils dépendent de l’expérience du médecin qui interprète le cliché radiologique. Enfin, cinq patients (sur les dix du groupe) ont déclenché des effets indésirables reliés directement, selon les auteurs, à la prise de chloroquine.
Dans la suite chronologique des publications sur le sujet, l’équipe marseillaise a publié le 20 avril 2020 sur son site Internet un article présentant sa dernière étude portant sur 1061 patients [34]. L’article a été publié sous forme de preprint, c’est-à-dire qu’il n’a pas encore été relu et validé par les pairs. Cette étude rétrospective, c’est-à-dire réalisée a posteriori (par opposition aux études prospectives de suivi de patients, qui ont une plus grande puissance statistique) portait sur 1 061 patients ayant reçu pendant au moins trois jours la bithérapie hydroxychloroquine à 200 mg/j et azithromycine. Les critères de jugement étaient le taux de mortalité, l’aggravation sur le plan clinique et la durée du portage nasal (charge virale). Les auteurs assument d’avoir fait une étude sans groupe témoin (avoir un groupe témoin n’aurait pas été éthique selon eux). Ce point est très débattu par ailleurs. Sur les 1 061 patients inclus, 92 % étaient classés comme ayant une évolution satisfaisante (en clair : ils ont guéri) et 4,3 % une mauvaise évolution, comprenant huit décès et dix transferts en soins intensifs. À l’inclusion, 95 % des patients avaient un faible score clinique (NEWS). Les patients ayant eu une mauvaise évolution étaient plus âgés (70 ans en moyenne) et présentaient plus de comorbidités (la moitié souffrait d’hypertension artérielle). Encore une fois, cette étude est ininterprétable en l’absence de groupe contrôle : l’évolution décrite pourrait être une évolution naturelle de la maladie, hydroxychloroquine ou pas. Les auteurs comparent également la mortalité à Marseille, 59,1 décès par million d’habitant, avec le « reste du monde » (le Rhône avec 124 décès par million d’habitant, l’Espagne et l’Italie avec environ 270 décès par million d’habitant, la Chine et la Corée du Sud autour de 2-3 décès par million d’habitant), suggérant (sans le dire explicitement) un lien de causalité fallacieux et que cette faible mortalité observée serait liée à la démarche thérapeutique locale utilisant l’hydroxychloroquine. L’Allemagne, citée par les auteurs, ne présente que 17 décès par million d’habitant, alors que ce traitement n’y est pas instauré particulièrement. Dans une analyse mise en ligne sur le site de l’IHU Méditerranée Infections dirigé par le Pr Raoult [39], il est évoqué, pour Marseille, « une mortalité de 0,7 % par Covid chez les patients positifs », donc supérieure à celle évaluée pour la France entière (0,53 %) dans une étude de l’Institut Pasteur [40], sans que l’on puisse toutefois mettre ceci sur le compte des incertitudes des évaluations ou d’un autre facteur (prise en charge, démographie, etc.). À noter que sur cette période, l’Insee le confirme : « Entre mi-mars et fin mars, la mairie de Marseille a fait face à des problèmes techniques ayant affecté ses transmissions à l’Insee. Le processus a repris début avril et des estimations ont été réalisées par l’Insee, pour le mois de mars, à partir de comptages fournis par la commune. Les données concernant les Bouches-du-Rhône sont donc plus fragiles que celles des autres départements et seront davantage révisées » [41].
Pour finir, mentionnons un essai randomisé non en aveugle conduit par une équipe chinoise sur 62 patients, dont 32 recevant de l’hydroxychloroquine à 400 mg/j et 31 recevant les soins classiques, pendant cinq jours. Les auteurs concluent à une amélioration significative sur la durée des symptômes, la durée de la fièvre et la durée de la toux dans le groupe traité [35]. Malheureusement, les résultats sont peu détaillés et certaines informations manquent, comme par exemple les pathologies sous-jacentes des patients. Cet article est également un preprint.
Conclusion
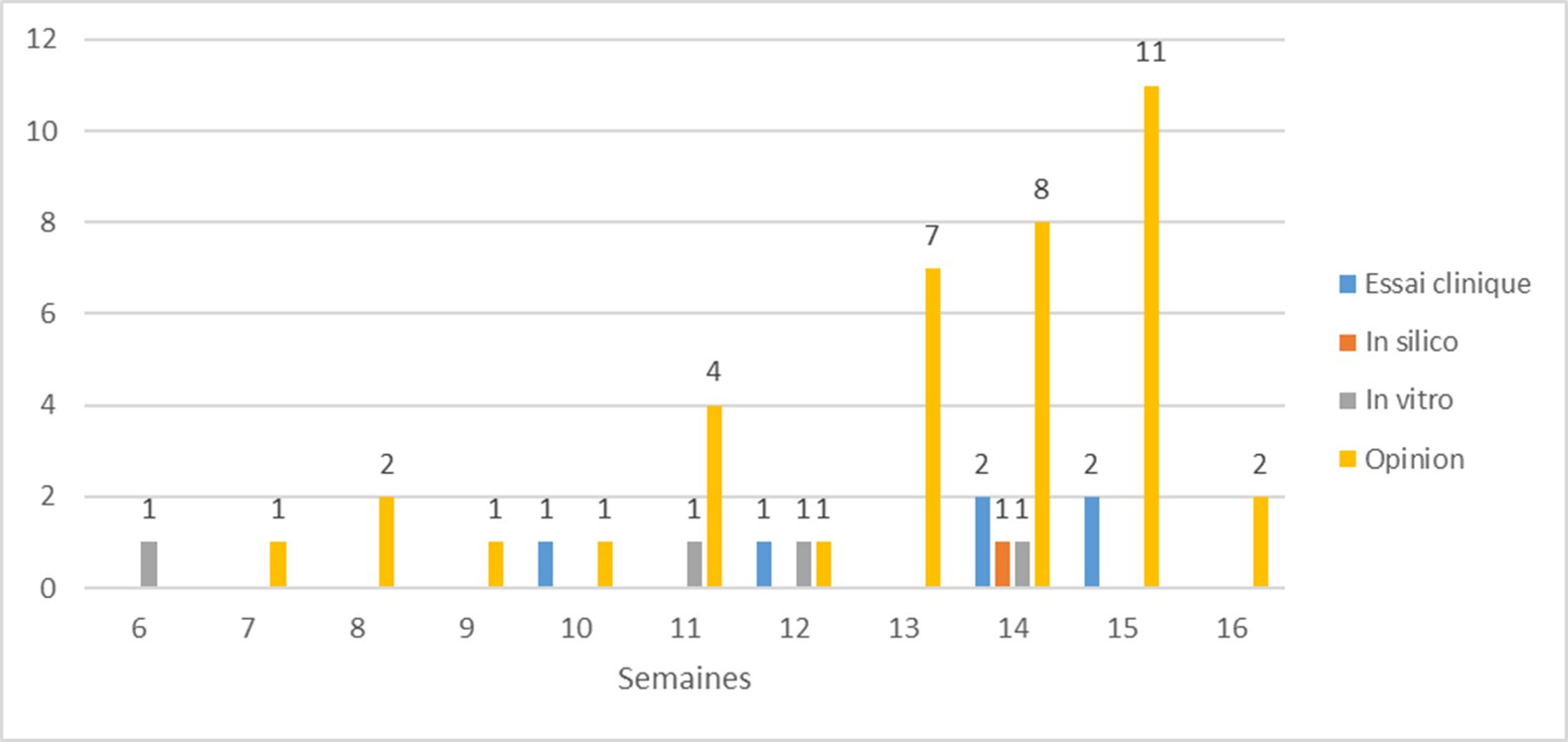
Ce petit historique (au 20 avril 2020) de l’utilisation de la chloroquine et de ses dérivés en virologie est important à considérer dans le contexte actuel. Comme nous l’avons vu, ces molécules ont suscité de nombreux espoirs pour le traitement d’un nombre non négligeable de virus. Malheureusement, à chaque fois, elles se sont avérées décevantes. Cette expérience doit inciter à nous montrer prudents quant à son utilisation pour le traitement de la Covid-19. En effet, aucune étude correctement menée sur le plan méthodologique n’a pu démontrer son efficacité de façon indiscutable. Les essais réalisés qui montrent une efficacité sont empreints de tellement de biais qu’ils ne sont finalement pas interprétables. De plus, des conflits d’intérêt manifestes ont été dénoncés pour plusieurs études (celles du Pr Raoult et de son équipe), avec un auteur ayant également la casquette de rédacteur en chef du journal dans lequel l’article était publié. Il est important de souligner, une fois de plus, l’importance du processus de relecture par les pairs (peer review) des articles scientifiques, seul gage d’un minimum de qualité méthodologique. En regard des quelques études cliniques réalisées, la littérature scientifique a vu exploser le nombre d’articles « d’opinion » et de revue (Figure 1). Ces articles ne doivent compter que pour ce qu’ils sont : des avis personnels d’experts.
Figure 1. Nature des publications concernant la chloroquine dans le cas de la Covid-19. « In silico » désigne des études sur des modèles informatiques. « Opinion » désigne les articles dans lesquels l’auteur donne son opinion, sur la base de son expertise ou d’une revue de la littérature.
Ainsi, dans l’état actuel des connaissances et en attendant les résultats des grands essais en cours, comme par exemple Discovery (Inserm), Solidarity (OMS) ou encore Hycovid à Angers, la communauté scientifique ne peut statuer sur ce sujet. Cet historique rappelle en outre un constat scientifique : un résultat in vitro est rarement transposable directement chez l’Homme. Bien sûr, des études fondamentales doivent également continuer afin de mieux comprendre comment la chloroquine et ses dérivés fonctionnent et pourraient être éventuellement optimisés sur le plan pharmacologique. Ces molécules ont par ailleurs démontré une efficacité dans d’autres pathologies notamment rhumatologiques, pour lesquelles une pénurie pourrait avoir des conséquences désastreuses [42].
1 | Jiang S, Hillyer C, Du L, “Neutralizing Antibodies against SARS-CoV-2 and Other Human Coronaviruses”, Trends Immunol, 2020.
2 | Weiss P, Murdoch DR, “Clinical course and mortality risk of severe COVID-19”, The Lancet, 2020, 395(10229):1014‑5.
3 | Santé publique France, « Infection au nouveau coronavirus (SARS-CoV-2), Covid-19, France et Monde »
4 | Cao B et al., “A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19”, N Engl J Med, 2020.
5 | Devaux CA et al., “New insights on the antiviral effects of chloroquine against coronavirus : what to expect for COVID-19 ?”, Int J Antimicrob Agents, 2020, 105938.
6 | Herold T et al., “Level of IL-6 predicts respiratory failure in hospitalized symptomatic COVID-19 patients”, Infectious Diseases (except HIV/AIDS), 2020.
7 | Mallucci L, “Effect of chloroquine on lysosomes and on growth of mouse hepatitis virus (MHV-3)”, Virology, 1966, 28:355‑62.
8 | Tsiang H, Superti F, “Ammonium chloride and chloroquine inhibit rabies virus infection in neuroblastoma cells. Brief report”, Arch Virol, 1984, 81:377‑82.
9 | Glushakova SE, Lukashevich IS, “Early events in arenavirus replication are sensitive to lysosomotropic compounds”, Arch Virol, 1989, 104:157‑61.
10 | Kronenberger P, Vrijsen R, Boeyé A, “Chloroquine induces empty capsid formation during poliovirus eclipse”, J Virol, 1991, 65:7008‑11.
11 | Sperber K et al. “Inhibition of human immunodeficiency virus type 1 replication by hydroxychloroquine in T cells and monocytes”, AIDS Res Hum Retroviruses, 1993, 9:91‑8.
12 | Vincent MJ et al., “Chloroquine is a potent inhibitor of SARS coronavirus infection and spread”, Virol J, 2005, 2:69.
13 | Khan M et al., “Assessment of in vitro prophylactic and therapeutic efficacy of chloroquine against Chikungunya virus in vero cells”, J Med Virol, 2010, 82:817‑24.
14 | Farias KJS et al., “Chloroquine interferes with dengue-2 virus replication in U937 cells”, Microbiol Immunol, 2014, 58:318‑26.
15 | Ferraris O et al., “Evaluation of Crimean-Congo hemorrhagic fever virus in vitro inhibition by chloroquine and chlorpromazine, two FDA approved molecules”, Antiviral Res, 2015, 118:75‑81.
16 | Liu J et al., “Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection in vitro”, Cell Discov, 2020, 6:16.
17 | Wang M et al., “Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro”, Cell Res, 2020, 30:269‑71.
18 | Yao X et al., “In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2)”, Clin Infect Dis Off Publ Infect Dis Soc Am, 2020.
19 | Maheshwari RK, Srikantan V, Bhartiya D, “Chloroquine enhances replication of Semliki Forest virus and encephalomyocarditis virus in mice”, J Virol, 1991, 65:992‑5.
20 | Vigerust DJ, McCullers JA, “Chloroquine is effective against influenza A virus in vitro but not in vivo”, Influenza Other Respir Viruses, 2007, 1:189‑92.
21 | Dowall SD et al., “Chloroquine inhibited Ebola virus replication in vitro but failed to protect against infection and disease in the in vivo guinea pig model”, J Gen Virol, 2015, 96:3484‑92.
22 | Freiberg AN et al. “Combined chloroquine and ribavirin treatment does not prevent death in a hamster model of Nipah and Hendra virus infection”, J Gen Virol, 2010, 91:765‑72.
23 | Zhang S et al., “Chloroquine inhibits endosomal viral RNA release and autophagy-dependent viral replication and effectively prevents maternal to fetal transmission of Zika virus”, Antiviral Res, 2019, 169:104547.
24 | Roques P et al., “Paradoxical Effect of Chloroquine Treatment in Enhancing Chikungunya Virus Infection”, Viruses, 2018, 10:268.
25 | Paton NI et al., « Chloroquine for influenza prevention : a randomised, double-blind, placebo controlled trial », Lancet Infect Dis, 2011, 11:677‑83.
26 | Paton NI, Aboulhab J, Karim F, “Hydroxychloroquine, hydroxycarbamide, and didanosine as economic treatment for HIV-1”, Lancet Lond Engl, 2002, 359:1667‑8.
27 | Paton NI et al., “Effects of hydroxychloroquine on immune activation and disease progression among HIV-infected patients not receiving antiretroviral therapy : a randomized controlled trial”, JAMA, 2012, 308:353‑61.
28 | Tricou V et al., “A randomized controlled trial of chloroquine for the treatment of dengue in Vietnamese adults”, PLoS Negl Trop Dis, 2010, 4:e785.
29 | De Lamballerie X et al., “On chikungunya acute infection and chloroquine treatment”, Vector Borne Zoonotic Dis Larchmt N, 2008, 8:837‑9.
30 | Chen J et al., “A pilot study of hydroxychloroquine in treatment of patients with common coronavirus disease-19 (COVID-19)”, Journal of Zhejiang University, 2020, 10.3785/j.issn.1008-9292.2020.03.03
31 | Gautret P et al., “Hydroxychloroquine and azithromycin as a treatment of COVID-19 : results of an open-label non-randomized clinical trial”, Int J Antimicrob Agents, 2020, 105949.
32 | Huang M et al., “Treating COVID-19 with Chloroquine”, J Mol Cell Biol, 2020.
33 | Gautret P et al., “Clinical and microbiological effect of a combination of hydroxychloroquine and azithromycin in 80 COVID-19 patients with at least a six-day follow up : A pilot observational study”, Travel Med Infect Dis, 2020, 101663.
34 | Million M, Raoult D, “Early treatment of 1061 COVID-19 patients with hydroxychloroquine and azithromycin, Marseille, France”
35 | Chen Z et al., “Efficacy of hydroxychloroquine in patients with COVID-19 : results of a randomized clinical trial”, Epidemiology, 2020.
36 | Magagnoli J et al., “Outcomes of hydroxychloroquine usage in United States veterans hospitalized with Covid-19”, Infectious Diseases (except HIV/AIDS), 2020.
37 | Gao J, Tian Z, Yang X, “Breakthrough : Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies”, Biosci Trends, 2020,14:72‑3.
38 | Gautret P, “Hydroxychloroquine and azithromycin as a treatment of COVID-19 : results of an open-label non-randomized clinical trial”, PubPeer.
39 | IHU MI, « Point sur l’épidémie de COVID-19 à Marseille ».
40 | Institut Pasteur, “Estimating the burden of SARS-CoV-2 in France”, HAL.
41 | INSEE, “Nombre de décès quotidiens par département”.
42 | Scuccimarri R, Sutton E, Fitzcharles M-A, “Hydroxychloroquine : a potential ethical dilemma for rheumatologists during the COVID-19 pandemic”, J Rheumatol, 2020.
Partager cet article
L' auteur

Dominique André
(pseudonyme) est médecin biologiste et virologue en laboratoire.
Plus d'informationsCovid-19

Science, expertise et décision à l’épreuve de la pandémie de Covid-19
Le 15 juillet 2020
Covid-19, hydroxychloroquine et traitement médiatique
Le 9 janvier 2023
Mauvaises conduites et Covid-19
Le 11 octobre 2022
Restaurer l’intégrité scientifique après la crise Covid-19
Le 4 octobre 2022Communiqués de l'AFIS















![[16 juin 2022 - Paris] Covid-19 : Deux ans d'épidémie, qu'avons-nous appris ?](local/cache-gd2/0f/33c69087dceb597afeb0e562895a7f.jpg?1675291840)