Placebo, es-tu là ?
Publié en ligne le 13 juin 2011 - Cerveau et cognition -
En fait, vous n’avez pas besoin de donner un placebo pour obtenir un effet placebo et donc nous pouvons maintenant réfléchir à comment nous pouvons maximiser la composante placebo dans des soins de routine.
Damien Finniss 2010
La scène se passe dans un bloc chirurgical où l’on se prépare à effectuer une opération de la cataracte. Le patient est étendu sur la table d’opération. On est passé quelques minutes plus tôt pour étaler sur sa cornée le gel anesthésique qui permettra de réaliser l’opération sous simple anesthésie locale. Le chirurgien arrive en compagnie de l’anesthésiste. Ils sont en grande discussion et ne semblent pas vraiment d’accord.
– « Il est prouvé, affirme le chirurgien, que dans un traitement médicamenteux, 30 % de l’action obtenue est due à l’effet placebo »
– J’en doute, rétorque son interlocuteur, je pense que cette histoire de placebo fait partie des mythes médicaux au même titre que le fait que nous n’utilisions que 10 % de notre cerveau, que les cheveux et ongles poussent après la mort ou que les téléphones cellulaires créent des interférences dans les hôpitaux 1 »
– Non, affirme le chirurgien, du ton de celui qui tient la première place, ce fait est avéré et a été prouvé par de nombreuses études ».
L’anesthésiste hoche la tête avec un léger sourire, mais ne rétorque pas. Quant au patient qui, par hasard, aurait beaucoup de choses à dire sur le sujet, il garde le silence, car la moindre des prudences veut qu’on ne polémique pas avec quelqu’un qui est en train de vous aspirer le cristallin.
Cette anecdote, authentique, serait sans intérêt si elle ne concernait pas deux membres du corps médical. Pourquoi pareille incertitude ? Pourquoi pareille méconnaissance d’un sujet pourtant fondamental ? Cette foi en un placebo surpuissant, magique et mystérieux, est chose courante dans le public et elle sert de justification au recours à des médecines non conventionnelles qui n’ont jamais été capables de présenter de preuves solides d’efficacité ; mais on voit qu’elle persiste toujours dans le corps médical.
Pour savoir si l’effet placebo est une réalité ou s’il est à placer dans la même catégorie que les esprits frappeurs, il est bon de remonter un peu dans l’histoire.
Historique de l’effet placebo
Bien qu’il soit connu depuis fort longtemps, la reconnaissance de l’effet placebo découle de la généralisation des études cliniques contrôlées (ECC) par la Cornell Conferences of therapy en 1946. La popularisation de cet effet ne sera réelle qu’après les publications de Beecher (1955) et de Haas (1959).
Beecher étudie 15 articles rendant compte du traitement de 1052 patients et estime l’effet placebo, toutes pathologies confondues, à une moyenne de 32 %. Ces résultats sont confirmés par Haas, quelques années plus tard, à partir de 1400 cas issus de 96 articles. Il trouve lui aussi une moyenne de l’ordre de 30 %, mais distingue de notables variations selon les pathologies. Les améliorations dans le domaine de la douleur pouvant aller de 15 % à 60 %.
La conséquence de ces articles sera la mise en place d’un modèle additif simple qui considère l’effet placebo comme la différence entre l’effet global observé et l’effet pharmacologique. Il est alors textuellement défini comme « le changement d’état clinique produit par l’administration d’un placebo ».
Cette définition est importante, car elle attribue une causalité (« produit par ») à ce qui n’est en fait qu’une corrélation. Il faudra attendre longtemps pour que cette conception soit remise en cause. La raison en est que l’effet placebo est un mécanisme fort peu connu, parce que fort peu étudié.
Ce manque d’intérêt vient sans doute du fait que l’effet placebo se positionne en concurrence avec l’action du médecin et lui retire un peu du mérite de la guérison. De plus, le placebo n’intéresse pas l’industrie pharmaceutique à laquelle on doit le financement de la majorité des études. Celle-ci se contente de rechercher l’effet pharmacologique de son produit et se soucie fort peu des autres mécanismes d’action.
En un demi-siècle, on recense une vingtaine d’études sur le placebo proprement dit, et quelques centaines seulement sur le placebo dans le cadre d’études pharmacologiques. Ceci est à comparer aux très nombreuses études réalisées sur les médicaments.
Les conséquences de cet état de fait sont nombreuses. Elles vont de la mise en avant, y compris dans des articles relativement récents, de nombreuses études anciennes à la méthodologie incertaine, à la persistance de certaines idées reçues – dont le fameux 30 % – et la non-remise en cause des modèles utilisés.
Les auteurs d’un article (Kienle et Kiene, 1997) qui fut l’un des premiers à désacraliser l’effet placebo écrivent : « Les fausses impressions d’effets placebo peuvent être produites de différentes manières ». Ils citent de nombreux exemples parmi lesquels : « L’amélioration spontanée », « la fluctuation des symptômes », « la régression à la moyenne », « la prise d’un traitement supplémentaire », « un biais dans l’échelle d’évaluation », « des réponses de politesse » et bien d’autres encore. Et ils constatent : « Ces facteurs sont encore fréquents dans la littérature moderne sur le placebo ».
Sachant que plus de 800 articles ont été analysés par les auteurs, on peut noter que toute référence antérieure à cette publication doit être prise avec la plus grande circonspection.
La remise en question
Cette remise en question viendra du fait que de nombreux chercheurs constatent qu’on ne tient pas compte de la guérison naturelle, ce qui est assez curieux dans la mesure où de nombreuses pathologies guérissent spontanément. Par exemple, le journal Prescrire, dans son numéro de février 2007, écrit, à ce sujet : « on estime qu’en l’absence de traitement, 50 à 70 % des cystites aiguës simples guérissent spontanément, après avoir été le plus souvent asymptomatiques pendant plusieurs mois ».
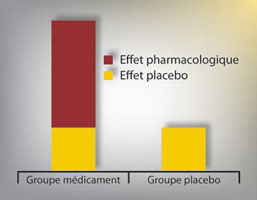
En fait, on appelle effet placebo le résultat obtenu dans le groupe qui est soumis à un placebo (Figure 1).
Il est donc nécessaire de concevoir une nouvelle modélisation dans laquelle l’effet constaté est égal à l’effet spécifique du médicament étudié, auquel vient s’ajouter un effet non spécifique complexe, dans lequel la guérison naturelle tient une bonne part. On aura donc maintenant le schéma de la figure 2. L’équation qui en résulte devient : effet observé = effet spécifique + guérison naturelle + un résidu que nous appellerons encore provisoirement effet placebo.
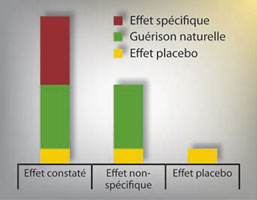
Mais, ce nouvel « effet placebo » n’est-il pas à son tour constitué d’éléments différents ? On comprend aisément que parmi ceux-ci apparaissent en premier lieu les erreurs de mesure faites lors de l’essai. Ces erreurs de mesure sont multiples et dépendent du type d’étude réalisée. Les plus connues sont : le phénomène de régression à la moyenne, l’effet Hawthorne, le paradoxe de Simpson, le phénomène Will Rogers, etc. On peut en imaginer d’autres ; par exemple, une imprécision dans l’inclusion des sujets lors de l’essai ou le fait que les patients consultent plutôt lorsqu’ils sont au sommet de la crise.
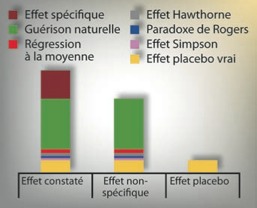
Si l’on retranche à nouveau toutes ces erreurs de mesure, le résidu peut prendre le nom d’« effet placebo vrai », comme l’a proposé Ernst (1995), afin de bien le distinguer du « faux » effet placebo dont on parle traditionnellement.(figure 3)
Les polémiques
Cet effet placebo est tellement réduit par rapport à la conception initiale que certains vont même jusqu’à se demander s’il existe vraiment. Le premier coup sérieux contre les idées reçues concernant l’effet placebo fut porté par Kienle et Kiene (1996).
Les auteurs eurent l’idée de reprendre l’étude de Beecher pour en vérifier la validité. Dans leur conclusion, ils écrivent : « Depuis 1955, lorsque Beecher a publié son classique “The Powerful Placebo”, il a été généralement admis que 35 % des patients présentant toute une grande variété de troubles peuvent être traités avec des placebos seuls. Au cours des dernières années, la moyenne des taux de guérison de 70 %, et jusqu’à 100 %, ont également été cités. […] Il a été postulé que des placebos peuvent prolonger la vie, que leurs effets se produisent dans la chirurgie, ainsi que dans la médecine… Dans cet article, la source du matériel qui forme la base scientifique de ces demandes a été examinée. L’analyse montre que les études sur lesquelles ces idées sont fondées, sauf peut-être dans l’asthme bronchique, ne peuvent en aucune manière justifier les conclusions tirées. La vérité est que l’effet placebo est contrefait par une variété de facteurs […] »
L’effet Hawthorne : la modification des comportements naturels de sujets d’étude en raison de leur participation à cette dernière peut entraîner une surévaluation des effets du traitement, en particulier dans le groupe contrôle.
La régression à la moyenne : l’inclusion de patients avec des valeurs très élevées ou très basses à l’entrée dans une étude donne l’illusion que la variabilité statistique des mesures ultérieures est une amélioration sous traitement.
Le paradoxe de Simpson : lorsque des facteurs déterminants (in)connus (« confounders ») influencent les données, le résultat global d’une étude (de cas témoins) peut être complètement modifié par des analyses de sous-groupes.
Le phénomène de Will Rogers : l’acroissement des possibilités diagnostiques ou l’augmentation artificielle de la prévalence d’une maladie peut améliorer le pronostic d’un patient sans que ses paramètres de mesure aient subi un quelconque changement.
Extrait de : « Quatre effets, phénomènes et paradoxes de la médecine. Leur signification et leurs racines historiques », Peter Kleist. Forum Med Suisse 2006 ;6 :1023–1027
Et les auteurs sont les premiers à affirmer qu’« une autre erreur de jugement est le manque de clarté du concept de placebo lui-même ». Ils concluent sans ambages « que la littérature, relative à l’ampleur et la fréquence de l’effet placebo, n’est pas fondée et largement surestimée, si elle n’est pas entièrement fausse ». Ils posent enfin la question de savoir si l’existence du soi-disant effet placebo « n’est pas en effet lui-même en grande partie, ou totalement, illusoire ».
C’est ce qu’on appelle lancer un pavé dans la mare.
Cependant, cette étude, pas plus que la suivante publiée un an plus tard par les mêmes auteurs sur le même sujet (Kienle et Kiene, 1997), ne provoquera de réactions, bien qu’elle présente toutes les qualités requises et qu’elle soit publiée dans un journal de référence.
Et pourtant, ce n’est pas pour rien qu’on parle aujourd’hui couramment d’« erreur de Beecher » ! Il faudra attendre 6 ans pour qu’une autre étude, arrivant aux mêmes conclusions, réveille la torpeur des milieux médicaux.
En 2001, Hrobjartsson et Gotzsche publient un travail s’appuyant sur 214 études regroupant 8525 patients. Leurs conclusions sont les suivantes : « Nous avons trouvé peu de preuves, en général, que les placebos aient eu des effets cliniques puissants [...] ils ont de petits avantages possibles dans les études qui s’appuient sur des résultats subjectifs et pour le traitement de la douleur » et ils concluent que « en dehors de la mise en place d’études cliniques, il n’y a aucune justification pour l’usage des placebos ».
Cette étude, qui va à l’encontre des idées reçues, va être, cette fois, largement contestée ; mais les controverses qui s’ensuivront seront très fertiles.
Pour mieux comprendre ce paradoxe, une autre équipe, Vase et al. (2002), reprend l’étude de Hrobjartsson en la séparant en deux méta-analyses suivant qu’il s’agit d’un essai sur le placebo ou d’un essai de médicaments comportant un groupe à évolution naturelle (c’est-à-dire qui ne reçoivent ni médicament, ni placebo). Il montre que les deux groupes de l’étude Hrobjartsson sont, en fait, deux groupes placebo, car les patients du groupe à évolution naturelle savent qu’ils font partie d’une étude clinique et sont régulièrement évalués par les médecins. Ainsi donc, l’utilisation ou non d’un « objet » placebo ne change rien, et c’est pourquoi les auteurs proposent une nouvelle définition : « la réponse placebo est la réduction de l’un des symptômes à la suite de la perception par le sujet des facteurs liés à l’intervention thérapeutique ».
On constate donc que la terminologie qui entoure ce fameux placebo est extrêmement ambiguë, puisque l’effet placebo n’apparaîtrait plus lié à l’objet placebo et que cette définition nouvelle nécessiterait de bien distinguer « l’effet placebo », de « l’effet mesuré sur le groupe placebo » et de « l’effet du placebo ».
On ne saurait espérer la compréhension du public (ni même celle du corps médical, qui ne dispose pas forcément du temps pour se pencher sur ces subtilités syntaxico-sémantiques) sans recourir à une clarification, en cessant d’utiliser le même mot dans plusieurs acceptions sans rapport entre elles.
Un essai de clarification

Il semble naturel, dans l’état actuel des choses, de distinguer deux cas. Si on est dans le cadre d’un essai clinique contrôlé, ce qui importe, c’est de déterminer l’effet spécifique du traitement. Le reste, qui se nomme « effet non spécifique », est constitué d’éléments complexes et n’intéresse pas le promoteur de l’étude qui cherche à évaluer l’efficacité spécifique d’une molécule donnée.
Dans le cadre clinique (traitement d’un patient) en revanche, l’effet constaté est égal à l’effet pharmacologique auquel s’ajoute la guérison naturelle et un effet que nous avons nommé « placebo vrai », mais qu’il serait préférable, pour les raisons indiquées plus haut, de désigner désormais par « effet contextuel » 2, comme l’ont proposé plusieurs chercheurs (Di Blasi et al., 2003) (Miller et Kaptchuk, 2008).
Les erreurs de mesure ont évidemment disparu dans ce cadre, ce qui explique que l’effet global puisse être légèrement inférieur à celui constaté dans le cas de l’étude clinique.
Mise en œuvre de l’effet contextuel
Reste à savoir quels sont les éléments qui peuvent entrer en jeu dans la mise en œuvre et dans l’optimisation de cet effet contextuel.
Le premier élément est le rituel thérapeutique : les résultats sont différents selon la voie d’administration, le goût, le nom, le prix, la couleur, etc. Plusieurs études ont confirmé l’action de certains de ces paramètres.
Le second tient aux conditions environnementales : personnalité et croyances du patient, attitude de son entourage, lieu où se réalisent des soins, attention de l’équipe soignante, etc.
Enfin, il semble bien que l’élément majeur soit la relation patient/praticien.
Afin de déterminer l’influence de ces trois facteurs, d’évaluer leur importance relative et de voir comment ils peuvent être combinés pour apporter une amélioration clinique, Kaptchuk (2008) a constitué trois groupes de patients atteints du syndrome du colon irritable. Les premiers ont été placés en observation sur une liste d’attente, les seconds ont reçu une acupuncture placebo simple, et les troisièmes une acupuncture placebo accompagnée d’une attention particulière du praticien (relation chaleureuse, mise en confiance, attention soutenue). Au bout de six semaines, on a constaté un soulagement respectivement de 28 %, 44 % et 62 %. L’auteur conclut que « les effets non spécifiques peuvent produire des résultats statistiquement et cliniquement significatifs, et la relation patient-médecin en est le principal composant »
Les mécanismes psychologiques
Les mécanismes psychologiques font intervenir deux éléments qui peuvent agir simultanément ou séparément : le conditionnement et la suggestion.
Le conditionnement
Le conditionnement est connu depuis les travaux de Pavlov. Celui-ci a montré que si on habituait un chien à ce que l’arrivée de sa nourriture soit accompagnée par des stimuli sonores, au bout d’un certain temps, le réflexe de salivation du chien pouvait être déclenché par les seuls stimuli, en absence de nourriture. On retrouve ce mécanisme lors de la prise d’un placebo, et Gotzsche (1994) a pu écrire dans The Lancet : « Une pilule de lactose a une action plus marquée chez des personnes ayant déjà réagi favorablement à la prise d’une benzodiazépine que chez celles qui n’en ont jamais pris ».
La suggestion
Le pouvoir de la suggestion est connu depuis longtemps. On peut citer son utilisation par Mesmer sous le fallacieux prétexte d’un prétendu magnétisme animal ou, plus près de nous, par la fameuse méthode Coué.
Des études plus récentes mettent en évidence son rôle dans la mise en œuvre de l’effet contextuel. Ainsi, Thomas (1987) a suivi 200 patients atteints de maladies fonctionnelles. Il les a divisés en 4 groupes recevant placebo/rien et consultation positive/négative. Le premier groupe reçoit donc placebo et consultation positive (assurance du bon diagnostic, certitude de guérison), le second, consultation négative (hésitation sur le diagnostic, manque de confiance dans l’évolution de la maladie) sans placebo et les 2 autres groupes soit placebo et consultation négative, soit consultation positive sans placebo. Après 2 semaines, 64 % des patients bénéficiant d’une consultation positive voient leur état s’améliorer contre seulement 39 % pour les patients bénéficiant d’une consultation négative. Mais on ne constate aucune différence significative selon qu’ils reçoivent ou non un placebo. L’amélioration constatée est donc due à la suggestion créée par le médecin et n’a rien à voir avec la prise ou non d’objet placebo.
Ceci confirme bien que, comme l’écrivent Bourreau et Coichard (2003) : « il est inutile de recourir à un placebo pour induire un effet placebo ». Ce qu’on pourrait écrire plus clairement aujourd’hui en disant que l’objet placebo n’est pas nécessaire à l’effet contextuel.
Mécanismes neurobiologiques
Comprendre les mécanismes psychologiques qui servent d’intermédiaires entre le contexte du soin et l’apparition d’un effet thérapeutique ne suffit pas. Encore doit-on chercher comment ces mécanismes psychologiques sont capables, à leur tour, de provoquer des modifications biochimiques et neurobiologiques qui, seules, peuvent être génératrices de résultats mesurables.
Les opioïdes endogènes
Ce n’est pas un hasard si la très grande majorité des études sur le placebo s’effectuent dans le domaine de la douleur, qu’elle soit artificiellement provoquée ou non. C’est en effet dans ce domaine qu’on obtient les effets non significatifs les plus importants. On ne peut que constater l’extrême importance de l’effet contextuel dans le soulagement de la douleur. C’est pourquoi l’hypothèse a été faite que l’action constatée était due à la sécrétion d’opioïdes par l’organisme du patient. Les résultats des études sur ce sujet sont assez nombreux et concordants. Ils confirment cette hypothèse (voir encadré).
Une étude (Levine et al., 1981) illustre parfaitement la puissance du contexte dans le traitement de la douleur. Les auteurs étudient l’action, en intraveineuse, de la morphine et d’un placebo sur 74 patients ayant subi l’extraction d’une troisième molaire. Deux heures après le début de l’anesthésie, tous les patients ont reçu un placebo (salin intraveineux) en ouvert1. Une heure après, chaque patient a reçu, soit un deuxième placebo en ouvert, soit 4, 6, 8 ou 12 mg de morphine, en double aveugle, par administration cachée. Le niveau de douleur a été évalué 50 minutes après en utilisant une échelle analogue visuelle. Le soulagement moyen de la douleur à la suite de l’administration du deuxième placebo s’est avéré être équivalent à celui obtenu après l’administration cachée de 4 à 6 mg de morphine et aucun patient n’a ressenti de soulagement complet, même à la dose la plus élevée de la morphine (12 mg).
On peut aussi citer parmi les études les plus significatives, celle de Petrovic et al., 2002, dans laquelle on a provoqué chez des volontaires une légère brûlure de la peau. Ils sont séparés en trois groupes qui reçoivent, soit un antalgique morphinique, soit un placebo, soit rien. En réalisant alors un TEP scan, on constate chez les patients soulagés que l’antalgique et le placebo sont associés à une augmentation de l’activité dans le cortex cingulaire antérieur rostral (RACC) et dans le tronc cérébral, des zones impliquées dans le soulagement de la douleur. Pour en avoir confirmation, on donne aux patients de la naloxone (antagoniste des morphiniques) et l’on constate l’arrêt du soulagement.
1 Lors d’une intervention « en ouvert » le patient reçoit les soins avec intervention du personnel soignant (pose d’intraveineuse, échanges verbaux...). En administration cachée, l’injection se fait sans intervention du personnel par une pompe automatique, à l’insu du patient.
Les neurotransmetteurs
La dopamine
Il a été remarqué que l’effet contextuel semblait actif dans la maladie de Parkinson. La maladie de Parkinson, une affection qui provoque la dégénérescence des neurones dopaminergiques, se traduit par un déficit en dopamine du système négro-strié et se manifeste par des troubles des mouvements.
De la Fuente-Fernandez et al. (2001) ont utilisé du raclopride marqué, une molécule se liant aux récepteurs dopaminergiques, pour détecter au TEP scan (tomographie par émission de positons scanner) les récepteurs cérébraux de la dopamine. Les malades recevaient soit une injection de lévodopa 3, soit un placebo. Ils ont constaté que le placebo produisait la même action sur les récepteurs de la dopamine, donc qu’il déclenchait probablement une libération de dopamine endogène dans le cerveau. Ils concluent : « Nos résultats indiquent que l’effet placebo dans la maladie de Parkinson est actif et est médité par l’activation du système dopaminergique nigrostrié endommagé ».
Encore faut-il avoir la certitude que cette constatation d’imagerie se traduit bien dans les résultats cliniques. Une étude plus récente (Fregni et al., 2006) vient en effet tempérer les résultats précédents. Elle étudie cette fois les effets obtenus, non seulement par le ressenti du patient, mais aussi par des tests objectifs. Les auteurs ont cherché à étudier les effets immédiats de deux types de placebo différents (pilule et simulacre de stimulation magnétique transcrânienne) et les ont comparés au traitement standard par la lévodopa. La fonction motrice subjective a été mesurée par une échelle visuelle analogique, et la fonction motrice objective par l’échelle unifiée de la maladie de Parkinson (UPDRS). La conclusion est que : « les interventions placebo dans la maladie de Parkinson produisent immédiatement une sensation subjective d’amélioration, mais le résultat n’est pas un facteur significatif de changement objectif par rapport au traitement avec la lévodopa ».
La sérotonine
Mayberg et al. (2002) réalisent une étude en double aveugle randomisée sur 17 patients qui sont hospitalisés pour six semaines en testant la fluoxétine (un antidépresseur) contre placebo. Ils réalisent un TEP Scan avant le traitement, une semaine après et, enfin, à la sixième semaine. Dans chaque groupe, ils vont trouver quatre patients améliorés et constateront chez ceux-ci une augmentation d’activité dans la région liée aux émotions. Pourtant, le soulagement sera moins durable avec le placebo.
Peut-on utiliser un placebo pour traiter un patient ?
Nous venons de voir que l’effet contextuel est un élément essentiel en ce qui concerne la douleur et sans doute aussi les diverses maladies fonctionnelles. Il agit sur la perception subjective, mais aucune preuve d’action n’a jamais été apportée dans le domaine des pathologies infectieuses ou tumorales. Quant à la réalité et l’importance de son action dans la maladie de Parkinson ou la dépression, elle reste à préciser.
Que le placebo, en tant qu’objet, soit utile lors des ECC (études cliniques contrôlées) est une évidence. Dans ce cadre, les comités d’éthique exigent que le patient soit informé et donne son « consentement éclairé ». Le problème, qui a été depuis longtemps débattu, est celui de son utilisation en clinique. Beaucoup d’arguments vont à l’encontre de son usage en pratique soignante.
A-t-on le droit de tromper le patient ? A-t-on le droit de se passer de son consentement ? Peut-on risquer de détériorer durablement la relation médecin/patient si celui-ci comprend qu’il a été trompé ?
Une meilleure connaissance du phénomène rend caduc ce type de questions. Dans la mesure où l’« effet placebo » n’est qu’un effet contextuel qui ne dépend pas de l’utilisation ou non d’un objet inactif, il peut et doit être utilisé en pratique soignante. Il peut sans doute se substituer à toute prescription dans certaines maladies fonctionnelles et, à coup sûr, potentialiser l’effet des médicaments prescrits dans de nombreux cas (antalgiques, antidépresseurs…).
Les auteurs d’une étude très récente (Finniss et al., 2010) explicitent parfaitement cette problématique lorsqu’ils écrivent : « Depuis de nombreuses années, les placebos ont été définis par leur contenu inerte et leur utilisation comme témoins dans les essais cliniques et les traitements dans la pratique clinique. Des recherches récentes montrent que les effets placebo sont de véritables événements psychobiologiques imputables au contexte thérapeutique global, et que ces effets peuvent être importants à la fois en laboratoire et en milieu clinique. Il est également prouvé que l’effet placebo peut exister dans la pratique clinique, même si aucun placebo n’est donné. Plus tard, la promotion et l’intégration des recherches cliniques et de laboratoires permettra des progrès dans l’utilisation éthique des mécanismes de placebo qui sont inhérents aux soins cliniques de routine et encouragera l’utilisation des traitements qui stimulent l’effet placebo ».
Alors ! Placebo es-tu là ? L’objet placebo est là et bien là ! Il sera encore longtemps irremplaçable dans la réalisation des incontournables études cliniques contrôlées.
L’effet du placebo, lui, est inexistant. Quant à l’effet « dit » placebo, si son existence est incontestable, quoique limitée, il conviendrait plutôt de le nommer simplement « effet contextuel », afin de mieux faire comprendre sa vraie nature et d’en faire disparaître la connotation magique.
Cet article est le texte d’une intervention faite le samedi 28 novembre 2009 au colloque de la 19e Journée Régionale du Groupe Aquitaine Douleur à Bordeaux.
1 | Beecher H.K., (1955) : “The powerful placebo”. JAMA ; 159 : 1602-1606.
2 | Boureau F. et Cochard C.G., (2003) « Douleur et effet placebo ». La lettre de l’institut UPSA de la douleur ; 19.
3 | De la Fuente-Fernandez et coll., (2001) “Expectation and dopamine release : mechanism of the placebo effect in Parkinson’s disease”. Science ; 293 : 1164-6.
4 | Di Blazi Z. et Kleijnen J., (2003). “Context effects. Powerful therapies or methodological bias ?” Eval Health Prof, 26, 166-179.
5 | Ernst E., Resch KL., (1995). “Concept of true and perceived placebo effects”, BMJ, 311, 551-553.
6 | Finniss G., (2010), “Biological, clinical, and ethical advances of placebo effects”, The Lancet, 375, Issue 9715, 686 – 695, 20
7 | Fregni F., (2006). “Immediate Placebo Effect in Parkinson’s Disease – Is the Subjective Relief Accompanied by Objective Improvement ?” European Neurology 56, No. 4, 2006.
8 | Gotzsche PC., (1994).“Is there logic in the placebo ?” Lancet, 344, 925-926.
9 | Haas (H.) et coll, (1959). “Das Placeboproblem” In Fortschritte der Arzneimittelforschung ; 1 : 279-454
10 | Hrobjartsson A, Gotzsche PC. (2001). “Is the placebo powerless ? An analysis of clinical trials comparing placebo with no treatment”. N Engl J Med, 344, 1594-1602.
11 | Kienle GS, Kiene H. (1997). “The powerful placebo effect : fact or fiction ?” J. Clin. Epidemiol, 50, 1311-1318.
12 | Levine JD. et coll, (1981) Analgesic responses to morphine and placebo in individuals with postoperative pain. Pain 10(3) :379-89.
13 | Mayberg HS. et coll. (2002).“The functional neuroanatomy of the placebo effect.” American Journal of Psychiatry 159, 728-737.
14 | Thomas KB. (1987). “General practice consultations : is there any point in being positive ?” BMJ, 294, 1200-1202.
1 Ces mythes et plusieurs autres ont été réfutés dans un article : Vreeman, R. C., & Carroll, A. E. (2007). “Medical myths”. Bmj, 335(7633), 1288-1289.
2 Dans la suite de cet article, le terme « effet placebo » désigne « l’effet placebo vrai » ou « effet contextuel ».
3 Dénomination pharmacologique internationale de la L-DOPA, substance utilisée dans le traitement de la maladie de Parkinson en augmentant, au prix d’une dépression due à la baisse du taux de sérotonine, le taux de dopamine.
Publié dans le n° 294 de la revue
Partager cet article
L' auteur

Jean Brissonnet
Agrégé de physique, a créé et développé le site www.pseudo-medecines.org. Il a été vice-président de l’AFIS de 2000 (…)
Plus d'informationsCerveau et cognition

De quoi l’hypnose est-elle le nom ?
Le 23 octobre 2015
Du nouveau sur l’effet placebo ?
Le 19 janvier 2024
Comment des souris amnésiques retrouvent la mémoire
Le 5 août 2023
« Zèbre » : cette embarrassante allégorie zoologique
Le 3 août 2023
Haut potentiel intellectuel et autisme
Le 31 juillet 2023